マウス iPS細胞・ES細胞から機能する神経線維(軸索)をもつ視神経細胞の作製に世界で初めて成功
疾患モデルマウスの細胞からiPS細胞を作製・視神経細胞に分化させ視神経疾患の研究に貢献
国立成育医療研究センター 病院 眼科医長・研究所 視覚科学研究室長の東 範行の研究チームは、昨年にヒトiPS 細胞から、機能する神経線維(軸索)をもつ視神経細胞(網膜神経節細胞)を作製することに、世界で初めて成功しました。これにより、重篤な視覚障害を起こす視神経疾患の原因や病態の解明、診断・治療の研究に大きな道が開けました。これに引き続き、今回はマウスのES細胞およびiPS細胞から、ヒトiPS細胞と同様の視神経細胞(網膜神経節細胞)を作製することに成功しました。これにより、さらに 幅広く視神経疾患の研究を展開することが可能となりました。
原論文情報
- 論文名:Generation of retinal ganglion cells with functional axons from mouse embryonic stem cells and induced pluripotent stem cells(Taku Tanaka,1) Tadashi Yokoi,1) Sachiko Nishina,1) Fuminobu Tanalu,2) Shu-ichi Watanabe,2) Noriyuki Azuma1)
1) Department of Ophthalmology and Laboratory for Visual Science, National Center for Child Health and Development, Tokyo, Japan
2) Department of Physiology, Faculty of Medicine, Saitama Medical University
) - 掲載雑誌:Investigative Ophthalmology & Visual Science
本プレスリリースのポイント
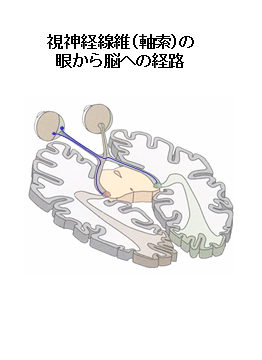
- 眼から脳へ視覚情報を伝達する視神経は、網膜に細胞体(網膜神経節細胞)があり、そこから長い神経線維(軸索)が伸びて、視神経管を通って脳に達する。これまでにヒトの視神経細胞を純粋に培養することはできず、動物から単離培養しても、神経線維(軸索)を温存することは不可能でした。当研究チームは、昨年、ヒトiPS細胞から、培養皿の中で視神経細胞(網膜神経節細胞)を作製することに、世界で初めて成功しました。
- 今回、マウスのES細胞およびiPS細胞からも同様に、視神経細胞(網膜神経節細胞)を作製することに世界で初めて成功しました。これにより、この視神経細胞の作製法が動物種や多能性幹細胞の種類を超えて、普遍的な技術であることが確認されました。
- これまでに多くの疾患モデルマウスが樹立され、殊にノックアウト・ノックインによる遺伝子改変マウスが作製されてきました。これらの研究では、疾患モデルマウスの生体を用いて行われてきましたが、視神経細胞のような中枢神経を採取して、培養皿で細胞の研究することはできませんでした。疾患モデルマウスの細胞からiPS細胞を作製し視神経細胞に分化させることによって、培養皿の中で研究を行うことが可能となり、新たな医療研究を展開する可能性が大きく開けました。
背景
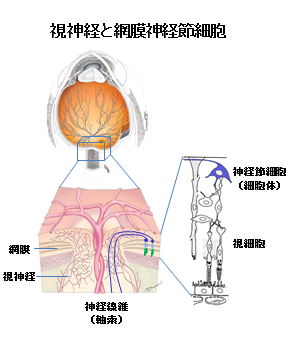
視神経は、眼と脳をつないで、眼の網膜に映った視覚情報を脳へ伝達しています。網膜では視覚情報が、受容器である視細胞からさまざまに修飾され、その後に網膜神経節細胞の長い軸索によって、視神経を通って脳へ到達します。したがって、視神経は、網膜にある細胞体(網膜神経節細胞)から伸びる長い神経線維(軸索)によって構成されています。視神経が障害されれば、重篤な視力障害が起こります。その原因として、視神経炎や遺伝性視神経障害、 虚血、外傷などさまざまな疾患がありますが、なかでも緑内障は40歳以上の日本人の5%が罹患し、治療中の患者数約30万人(厚生省患者調査2002年)、潜在患者数は400万人と非常に多く、我が国の失明原因の第1位(約25%)を占めています。
いろいろな視神経疾患の病態解明や薬剤効果の判定には、これまで動物モデル(in vivo実験)が使われて きました。一方、培養皿でのin vitro実験では、動物の網膜から視神経細胞(網膜神経節細胞)が単離培養されて用いられていますが、採取して培養皿で生存可能な動物の視神経細胞(網膜神経節細胞)は未熟ものに限られ、さらに神経線維(軸索)が千切れてしまっており殆どありません。視神経は中枢神経なので、ヒトでは採取することが不可能です。このように、視神経疾患の病態研究や創薬の研究は、これまで十分に行われてきませんでした。まして、視神経疾患における遺伝子治療、細胞の移植や再生医療は、動物実験でさえ殆ど行われていません。
再生医療の分野では、ES細胞やiPS細胞などの多能性幹細胞の研究が進められています。ES細胞やiPS細胞から網膜やその一部分である視細胞を作る研究は行われてきましたが、培養皿の中で長い軸索をもつ視神経細胞(網膜神経節細胞)を作ることは、非常に難しいと考えられてきました。
視神経は軸索で構成されており、そこに病気が起こるので、視神経疾患の研究においては、長い軸索をもつ網膜神経節細胞を得ることが、どうしても必要でした。
国立成育医療研究センター 病院 眼科医長・研究所 視覚科学研究室長の東 範行の研究チームは、昨年、 ヒト iPS 細胞から視神経細胞(網膜神経節細胞)を、培養皿の中で作製することに世界で初めて成功しました。これは、ヒト皮膚由来のiPS 細胞を培養し、外から形態形成遺伝子などを導入することなく、培養条件のみによって、iPS細胞から網膜神経節細胞に分化させることができる、画期的な細胞技術です。
このヒトiPS 細胞由来の神経細胞(網膜神経節細胞)の作製技術は、視神経を障害する疾患の病態解明や診断技術の研究、治療のための創薬、視神経の移植や再生医療などの臨床研究、視神経の発生、神経線維成長における経路探索のメカニズム、視覚成立の分子メカニズムなど、視覚生理学、神経学の基礎研究に大きく貢献すると考えられます。
研究手法と成果
今回、同研究チームは、同じ技術を用いて、マウスのiPS細胞およびES細胞からも同様に視神経細胞(網膜神経節細胞)を作製することに成功しました。
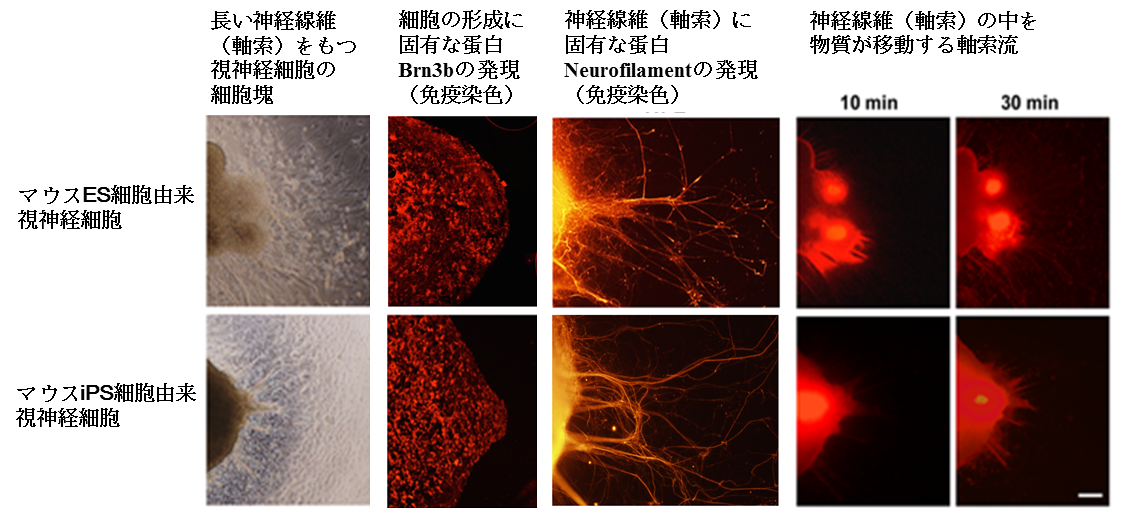
作製された神経細胞は、1-2cmにも及ぶ長さの神経線維(軸索)をもっていました。そして、視神経細胞(網膜神経節細胞)に特有な構造や蛋白がすべて存在していることが、免疫染色、電子顕微鏡観察、分子生物学的方法によって証明されました。
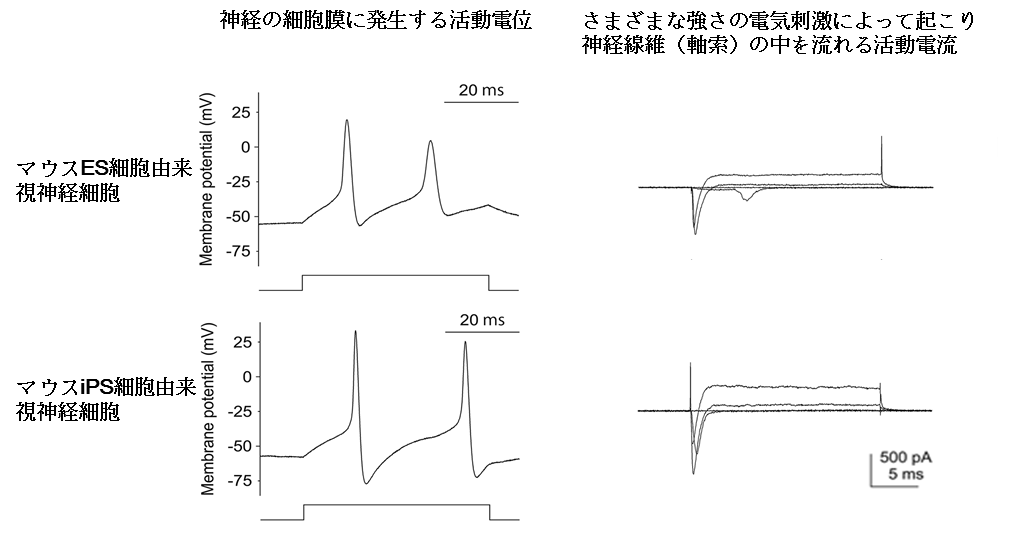
神経としての機能については、神経線維(軸索)に軸索流(軸索の中のミトコンドリアなどの物質の流れ)が見られ、神経情報伝達の電気生理反応(活動電位、活動電流)があることが証明されました(担当:埼玉医科大学医学部生理学 渡辺修一教授、 田丸文信助教)。作られた視神経細胞(網膜神経節細胞)は、構造・機能ともに十分に成熟したものでありました。
これにより、この視神経細胞の作製法が、動物種や多能性幹細胞の種類を超えて、普遍的な技術であることが確認されました。
作製された神経細胞は、1-2cmにも及ぶ長さの神経線維(軸索)をもっていました。そして、視神経細胞(網膜神経節細胞)に特有な構造や蛋白がすべて存在していることが、免疫染色、電子顕微鏡観察、分子生物学的方法によって証明されました。
神経としての機能については、神経線維(軸索)に軸索流(軸索の中のミトコンドリアなどの物質の流れ)が見られ、神経情報伝達の電気生理反応(活動電位、活動電流)があることが証明されました(担当:埼玉医科大学医学部生理学 渡辺修一教授、 田丸文信助教)。作られた視神経細胞(網膜神経節細胞)は、構造・機能ともに十分に成熟したものでありました。
これにより、この視神経細胞の作製法が、動物種や多能性幹細胞の種類を超えて、普遍的な技術であることが確認されました。
今後の展望・コメント
この細胞作製技術によって、我々は初めて、機能がある神経線維(軸索)をもつ視神経の培養細胞を手に入れることができるようになりました。ヒトiPS細胞から視神経細胞を作製したことは、ヒト疾患の研究を行う上で大きな成果でした。しかし、多くの研究がまずマウスを用いて行われていることを考えれば、マウスの細胞から視神経細胞(網膜神経節細胞)を作製して培養皿(in vitro)で研究することが可能になった意義は非常に大きいと考えます。これを用いて、今後さまざまな方向に応用できることが期待されます。まず、視神経を障害する疾患の病態解明や診断技術の研究に大きく貢献すると考えられます。これまでに、膨大な数の疾患モデルマウスが作られてきました。中でも、疾患の原因遺伝子を壊したノックアウトマウス、変異した遺伝子を組み込んだノックインマウスのような遺伝子改変マウスが多く作製されてきました。この疾患モデルマウスは生体を用いた研究(in vivo)が中心で、視神経細胞(網膜神経節細胞)を採取する培養皿内の研究(in vitro)では、採取して培養皿で生存可能な動物の視神経細胞(網膜神経節細胞)は未熟ものに限られ、かつ神経線維(軸索)が千切れてしまっており殆どありませんでした。今回の技術により、疾患モデルマウス患者由来(皮膚や血液)細胞をiPS細胞化し、そこからこの成熟し、長い神経線維(軸索)をもつ視神経細胞(網膜神経節細胞)を作製すれば、疾患iPS細胞になります。これを解析すれば、疾患の原因や発生過程、病態の分子メカニズムを解明することができます。ここから、新たな診断技術が開発されることでしょう。これまでに作られてきた疾患モデルマウスの研究方法に、新たに大きな可能性が開けたことになります。
治療の研究にも大きく貢献するでしょう。さまざまな治療薬の効果を、時間や濃度など条件を変えて検討することができます。神経線維(軸索)が障害され死滅することを予防、抑制する神経保護薬、あるいは神経線維(軸索)の再生・可塑性を促す神経再生薬の開発など、視神経疾患を治療するための創薬にもつながります。
このように、さまざまな視神経疾患ごとに病態解明・治療の研究を行うことができますが、なかでも国民の失明原因の第1位である緑内障の病態解明、治療に大きく貢献することが期待されます。
まったく新しい治療が開発されることも期待できます。これまで、視神経の移植や再生医療の研究はほとんど進んでいませんでした。視神経は経路が長く、投射も複雑なので、移植しても視覚を復元させることは困難と思われるからです。しかし、再生医療の移植技術は日進月歩であり、この視神経細胞(網膜神経節細胞)を移植して神経線維(軸索)が脳に到達し、視覚が復元する日が来ると思われます。このような新規治療法は、いきなりヒトで行われることはありません。まずはマウスのような実験動物で先駆的な研究が行われ、大型動物の研究を経て、初めてヒトに応用されます。その点で、マウスで移植可能な視神経細胞(網膜神経節細胞)を得ることができるのは、再生医療の研究を大きく進歩させることでしょう。
さらに、神経学の基礎研究にも貢献が期待でき、視神経の発生、グリア細胞等との関係、神経線維成長における経路探索のメカニズム、視覚成立の分子メカニズムなど、視覚生理学、神経学の基礎研究にも大きく役立つと考えられます。
以上のように、この視神経細胞(網膜神経節細胞)の作製技術は、基礎から臨床にわたる研究に広く貢献することができます。失明の恐れがある重症視神経疾患の患者さんにとっても、大きな福音になることでしょう。
マウスのiPS細胞およびES細胞から作製した視神経細胞と、ヒト多能性幹細胞から作製した視神経細胞(網膜神経節細胞)を合わせて、疾患の研究や薬の効果判定に利用する研究を進めているところであり、その研究成果もまもなく発表できる予定です。
用語解説
- 幹細胞(stem cell):別の種類の細胞に分化(発生における特別な細胞への変化)する能力を持つとともに、自分と同じ 細胞が際限なく増殖できる細胞。生体内では、臓器の発生や組織の維持において、分化する細胞の源を供給する役割を担っている。人工的に作られ、さまざまな細胞に分化する能力を獲得した細胞は、人工多能性幹細胞と呼ばれ、ES細胞とiPS細胞が代表的である。
- ES 細胞:受精卵から発生を僅かに進めた初期胚から作製され、さまざまな細胞・組織に分化することができる人工多能性幹細胞。再生医療において、重要なソースである。ヒトES細胞は、ヒト生命の源を使って作るので、それを 用いた研究は、施設のみならず文部科学省の厳しい審査と制約のもとで行われる。
- iPS 細胞:皮膚や血液などの体細胞に4つの遺伝子(山中因子)を導入することによって作製される人工多能性幹細胞。ES細胞と同様、多能性幹細胞。さまざまな細胞・組織に分化することができ、再生医療において期待されるソースである。皮膚や血液など材料は比較的容易に手に入るだけでなく、体細胞から作られるのでES細胞のような倫理的制約が少ない。重要なことは、患者の細胞から作れば、疾患の素因をもつ疾患iPS細胞となり、疾患の分子メカニズムの解明や、有効な薬剤の開発を行えることである。疾患素因をもつES細胞を作ることは難しいので、これはiPS細胞の大きな利点である。
- 動物モデル(in vivo実験):疾患が自然に発症する動物(多くは遺伝子変異をもつ)が発見されて解析されることもあるが、最近はヒトの疾患でみつかった遺伝子の働きを消す(ノックアウト)あるいは変異を導入する(ノックイン)動物が作られることが多い。大部分はマウスかラットである。これらは病態の研究に役立つものの、動物とヒトでは異なることが多く、 とくに薬剤の効果が大きく異なる点が問題となる。ヒト細胞を用いた研究が必要である。
- 培養(in vitro)実験:薬剤の効果判定は、培養皿の中に細胞を撒いて、培養液内に薬剤を投与して行う。培養皿を並べれば、薬剤の種類、濃度を変えて検討し、経時的変化も観察できる。 ヒト細胞の方が動物細胞に比べはるかに好ましいが、ヒトの皮膚や血液などは採取しやすいものの、神経細胞ことに中枢神経は採取できないので、使用することはできない。
- 神経細胞(ニューロン)と軸索:神経系の細胞は、1つがニューロンと呼ばれ、細胞の本体である細胞体と電気信号を伝達する線維(軸索)で構成されている。他に、隣接する細胞と情報伝達する短い樹状突起が存在する。神経が長い距離をわたって電気信号を伝達するためには、軸索が何より重要である。神経の多くの疾患は、細胞体だけでなく軸索が障害されて起こるので、疾患の研究に軸索の観察は欠かすことができない。
- 視神経細胞(網膜神経節細胞):視神経は、眼と脳をつないでおり、眼の網膜に映った視覚情報を脳へ伝達する。網膜では視覚情報が、受容器である視細胞で受け取られた後に、双極細胞、水平細胞、アマクリン細胞等の次の段階の細胞に伝達されてさまざまに修飾され、その後に網膜神経節細胞の細胞体に伝達される。その情報は、電気信号として、長い軸索によって、視神経内を通って脳へ到達する。視神経細胞は、脳の一部であり、中枢神経に属する。
- 自己分化:発生において初期の幹細胞が各臓器の特殊な細胞へ分化する時は、それぞれの分化を誘導する遺伝子(形態形成遺伝子)が、自動的に働く。これを自己分化と言う、眼の発生では、4000を超える形態形成遺伝子が働くと考えられている。人工多能性幹細胞から特殊な細胞へ分化を誘導する場合、その形態形成遺伝子を外から細胞内に入れて作ることは比較的容易であるが、培養条件によっては細胞内で遺伝子を自動的に働かせ自己分化させることが非常に難しい。再生医療などでは、余計な遺伝子を外から入れない方が好ましい。
- 細胞マーカー:各々の特殊な細胞に固有に働くあるいは存在する物質で、主に蛋白あるいはその設計図である蛋白。培養実験で、目的の細胞が出来ているかを確認する場合に調べられる。分化における形態形成遺伝子あるいは蛋白(形態形成因子)、あるいは細胞の機能や構造に固有の遺伝子、蛋白が用いられることが多い。
- 軸索流:神経線維(軸索)の中では、栄養因子などさまざまな物質が流れている。神経線維の機能として調べられることが多く、細胞の1か所に流れる物質を注入して、軸索全体に広がって行くかどうかで確認する。
- 活動電位・活動電流:神経線維(軸索)が、電線のように、情報を電気信号によって伝達する過程で発生する電位と電流。電位差は軸索の細胞内外にあり、電流は細胞体から軸索終末の方向に流れる。細胞内に細い電極を刺して検出する。
- 視神経疾患(視神経症):形成異常(先天異常)や遺伝素因による変性症の他に、感染、炎症、外傷などさまざまな原因で起こる。長い神経線維(軸索)が主に侵されやすい。したがって、神経疾患の研究には、軸索の評価が必須である。
- 緑内障:眼球の中を循環している房水の排水路が詰まり、眼内圧が上昇して、視神経細胞の軸索を圧迫され細胞死に至る視神経障害。加齢とともに増加し、40歳以上の約5%が罹患し、治療中の患者数約30万人、潜在患者数は400万人と非常に多く、我が国の失明原因の第1位(25%)を占めている。
- 疾患モデルマウス:マウスに薬物投与等のさまざまな操作を加え、ヒト疾患に類似した状態を作り出したもの。これを用いて、ヒト疾患の病態を類推し、治療探索の研究を行う。遺伝病における遺伝子の異常をもつ遺伝子改変マウスが代表的。
- 遺伝子改変マウス:遺伝子組み換え技術によって、ヒト疾患の原因遺伝子の異常を組み込んだ疾患モデルのマウス。原因遺伝子を破壊したノックアウトマウスと、原因遺伝子の変異を組み込んだノックインマウスがある。
- 疾患iPS細胞:患者の皮膚や血液などの細胞から作製したiPS細胞で、疾患の素因をもち、ことに遺伝疾患では原因遺伝子の変異をもつので、疾患の病態解明や治療薬の評価に役立つ。ただし、iPS細胞のままでは無意味で、目的の細胞に分化させる技術(視神経疾患の研究では視神経細胞に分化させる)があって、初めて研究ができる。
- 神経保護:多くの視神経疾患は、神経線維(軸索)が傷害され、細胞全体が自己的に死滅する(アポトーシス)。この細胞死を予防あるいは、遅らせることを目的とする薬物治療。神経保護薬はさまざまな候補があるが、ヒト神経系細胞を培養して評価できる手段は極めて稀で、多くは動物モデルや動物の培養細胞が用いられてきた。
- 再生医療:失われた組織を、多能性幹細胞を用いて復元する医療。ただし、ES細胞やiPS細胞を移植しただけでは再生は起こらず、まず目的とする細胞(視神経障害なら視神経細胞)にまず分化させ、それを移植する必要がある。
- グリア細胞:脳や視神経などの中枢神経細胞の周りに存在する支持細胞。ただし、機械的支持だけでなく、神経栄養因子や神経栄養因子を供給して、神経線維(軸索)の生存・維持を行っていると考えられる。
- 神経線維の経路探索:神経線維(軸索)が伸びていく時、神経成長因子や抑制因子等のさまざまな物質がその経路を誘導していると考えられている。視神経の伸長経路は、中枢神経の中でも最も長く複雑である。
- 本件に関する取材連絡先
-
国立成育医療研究センター 企画戦略局 広報企画室
03-3416-0181(代表)
koho@ncchd.go.jp
月~金曜日(祝祭日を除く)9時〜17時
※医療関係者・報道関係者以外のお問い合わせは、受け付けておりません。