「αβT細胞&B細胞除去ハプロ移植」の医師主導治験を開始 移植合併症の大幅な軽減に繋がる移植法の普及を目指して
国立成育医療研究センター(所在地:東京都世田谷区大蔵、理事長:五十嵐隆)の小児がんセンター 井口晶裕、遺伝子細胞治療推進センター 内山徹、東京大学医学部附属病院(所在地:東京都文京区本郷、病院長:田中栄)の小児科 加藤元博らの研究グループは、造血幹細胞移植の際にHLA[1]の合致するドナーがいない患者を対象とした「αβT細胞&B細胞除去ハプロ移植」の医師主導治験を開始しました。
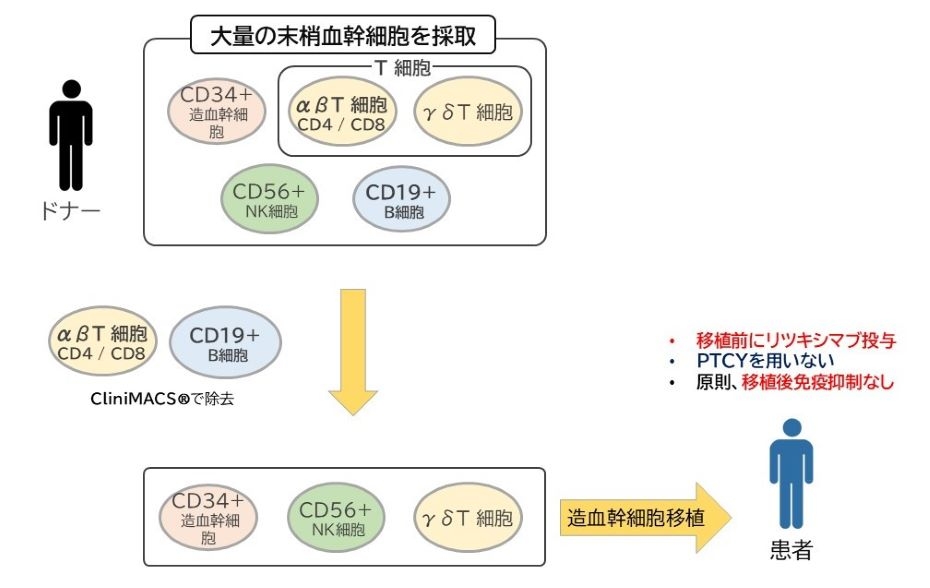
「αβT細胞&B細胞除去ハプロ移植」は、HLAが半分合致するドナーの造血幹細胞からαβT細胞とB細胞を除去して移植する治療法です。欧州では小児を中心に広く実施されていますが、日本ではαβT細胞&B細胞を除去する機器が承認されておらず、保険適用されていません。
本治験では、「αβT細胞&B細胞除去ハプロ移植」を行ったときの有効性(移植後の生着の状況、重症GVHD(移植片対宿主病)[2]の発症予防効果、PTLD(移植後リンパ増殖疾患)[3]の発症抑制効果)と安全性を調べ、日本においてもこの移植法が欧州と同様に行えるかどうかを確認します。
なお、αβT細胞を除去すると、PTLD(移植後リンパ増殖疾患)のリスクが高くなるため、本治験ではB細胞除去に加えて移植前に抗がん剤の「リツキシマブ」を投与して対策します。
[1] HLA(ヒト組織適合性抗原):身体の様々な細胞にある、ヒト白血球抗原という型。造血幹細胞移植や臓器移植の際には、HLAが合致しないと異物として認識し攻撃してしまう。
[2] GVHD(移植片対宿主病): ドナー由来のリンパ球がレシピエントの正常な臓器を異物とみなして攻撃すること。
[3] PTLD(移植後リンパ増殖疾患):臓器移植や造血幹細胞移植を受けた人に起こることがある、免疫の異常でリンパ球が異常に増えてしまう病気。
プレスリリースのポイント
- 「αβT細胞&B細胞除去ハプロ移植」は、欧州では小児を中心に広く実施されていますが、日本ではαβT細胞&B細胞を除去する機器が承認されておらず、保険適用されていません。
- 本医師主導治験では、「αβT細胞&B細胞除去ハプロ移植」を行ったときの有効性(移植後の生着の状況、重症GVHD(移植片対宿主病)の発症予防効果、PTLD(移植後リンパ増殖疾患)の発症抑制効果)と安全性を調べ、日本においても、本移植法が欧州と同様に行えるかどうかを確認します。
- 本治験の対象患者は、ファンコニ貧血のようなDNA修復障害を持つ患者さん、重症複合型免疫不全症(SCID)のような乳児期に移植が必要な患者さん、その他の疾患でも移植後シクロフォスファミド(PTCY)の使用が困難な患者さんです。
背景
ハプロ移植はHLAが半分合致するドナーからの移植で、一般的にはドナー細胞からの免疫反応(GVHD(移植片対宿主病))や生着不全のリスクが高い移植です。ハプロ移植ではHLAの不一致とそれに伴う合併症に対応するため、移植後に抗がん剤であるシクロホスファミドを大量に使用したり(PTCY)、強い免疫抑制療法を行ったりしてきました。しかし、移植前処置の抗がん剤や放射線治療に加えてPTCYを行うことは、治療関連毒性や晩期合併症のリスクが増加する問題があります。また、移植後に強い免疫抑制療法を行うと感染症のリスクが高くなること、腎障害や微小血管障害など免疫抑制剤自体の副作用が起こるという問題もあります。
「αβT細胞&B細胞除去ハプロ移植」は、少子化によるドナー不足に対応し、移植合併症の大幅な軽減につながることが期待されます。そのため、小児および成人を含めた造血幹細胞移植の有力な移植法のひとつとして普及することが望まれています。
治験登録基準
- 以下のいずれかに該当し、移植後シクロホスファミド(PTCY)治療を用いた移植方法ができないと判断された患者さん
・ファンコニ貧血(FA)などのDNA修復障害のある患者さん
・重症複合型免疫不全症(SCID)など、乳児期早期に造血幹細胞移植が必要な患者さん
・アントラサイクリン[4]投与量が最大量(ドキソルビシン換算で500mg/m2)に達している、またはシクロホスファミドのアレルギーなどのため大量投与できない患者さん - 造血幹細胞移植が必要だがHLA 7/8抗原(A、B、C、DRB1)一致、あるいは8/8抗原一致のドナーがいない患者さん
- ハプロ一致ドナー(HLA半合致ドナー)が2名以上いる患者さん
- 登録時に、生後3か月以上18歳未満の患者さん
※ただし、参加条件①~④を満たしていても登録できない場合がございます。
[4] アントラサイクリン:抗生物質由来の抗がん剤グループで、ドキソルビシン、イダルビシンなど複数の抗がん剤の総称。
実施医療機関
国立成育医療研究センター(治験責任医師:小児がんセンター 井口晶裕)
東京大学医学部附属病院(治験責任医師:小児科 加藤元博)
治験に関する問い合わせ先
国立成育医療研究センター 臨床研究センター 臨床研究コーディネートユニット
電話:03-5494-7120(内線5371)
- 本件に関する取材連絡先
-
国立成育医療研究センター 企画戦略局 広報企画室
03-3416-0181(代表)
koho@ncchd.go.jp
月~金曜日(祝祭日を除く)9時〜17時
※医療関係者・報道関係者以外のお問い合わせは、受け付けておりません。



