精子のX染色体ゲノム異常による致死的な発生阻害を、卵子のX染色体が救うことを発見
不妊・不育症、X染色体に関連する難治疾患の発症機序解明の手掛かりとして期待
国立成育医療研究センター研究所の福田篤上級研究員と阿久津英憲生殖医療研究部長のグループは、近畿大学の佐渡敬教授らとともに、精子に致死的なゲノム異常ある場合でも卵子側の働きを誘導することで成体まで得られることをマウスを使った実験で可能としました。これは、不妊・不育症やX染色体に関連する難病の発症機序解明に向けた重要な発見であると言えます。
原論文情報
- 論文名:Maintenance of Xist imprinting depends on chromatin condensation state and Rnf12 dosage in mice.(Atsushi Fukuda, Atsushi Mitani, Toshiyuki Miyashita, Takashi Sado, Akihiro Umezawa, Hidenori Akutsu.)
- 掲載誌:PLOS Genetics, 2016, October 27
プレスリリースのポイント
- これまで、受精後、卵子X染色体(Xm)全体の活性調節を担う「しるし」として、卵子X染色体上に位置しタンパク質をコードしない遺伝子であるXist発現を調節する、ヒストンの化学的修飾の存在意義を発見しました。
この度マウスにおいて、胚性致死となる精子Xistゲノム異常受精胚に体して特定の物質を注入することで、卵子X染色体の働きを変化させ 通常流産してしまうところを健康な産仔を得ることに成功しました。 - X染色体不活性化の破綻は、着床後の正常な発生を阻害することから、原因不明の反復性流産との関連も示唆されており、こうした不妊・不育症に関わる疾患ではゲノムレベルでの異常が認められない症例も多く、今回の発見は後発性の原因不明な不妊・不育症を克服する突破口となり得ます。
- 卵巣腫瘍や乳癌などの女性腫瘍の発症機序解明、そして安全で効果的な再生医療のためのES細胞やiPS細胞の品質にも関わる重要な成果でもあり、再生医療の発展に大いに貢献するものであると考えます。
背景
哺乳類の雌雄間では、性染色体であるX染色体の数が異なる。オス(1本のX染色体と1本のY染色体)では、常時X染色体が活性化しています。一方、メス(2本のX染色体)では、どちらか一方のX染色体が抑制されています。遺伝子の発現量が同じであることが生存には必須であり、X染色体に関しては、遺伝子発現量の補正機構が種を超えて存在しています(補足説明①)。この機構はX染色体不活性化とも言われ、中心的役割を担う分子としてXist(イグジスト)が知られています(補足説明①)。
哺乳類では、この現象が受精直後からみられ、正常な胎盤及び胚の発育には必須です。哺乳類のモデル動物では、受精後卵子由来のX染色体が優先的に働く「仕組み」が備わっています。研究グループは、これまでに、その「仕組み」がDNAに結合する核(ヒストン)タンパク質の化学的修飾であることを明らかにしてきました(参考文献1;Fukuda A, et al. Nature Communication 2014)。このメカニズムを用いて流産を繰り返す胚を助けられるような研究が期待されていました。
研究手法と成果
この度、マウスモデルを用いて、受精卵に対しゲノム編集など遺伝子改変を行わず、特定の物質により機能していない遺伝子を働かせ胚性致死の受精胚を正常に発生させ健康な成体を得ることに成功しました。
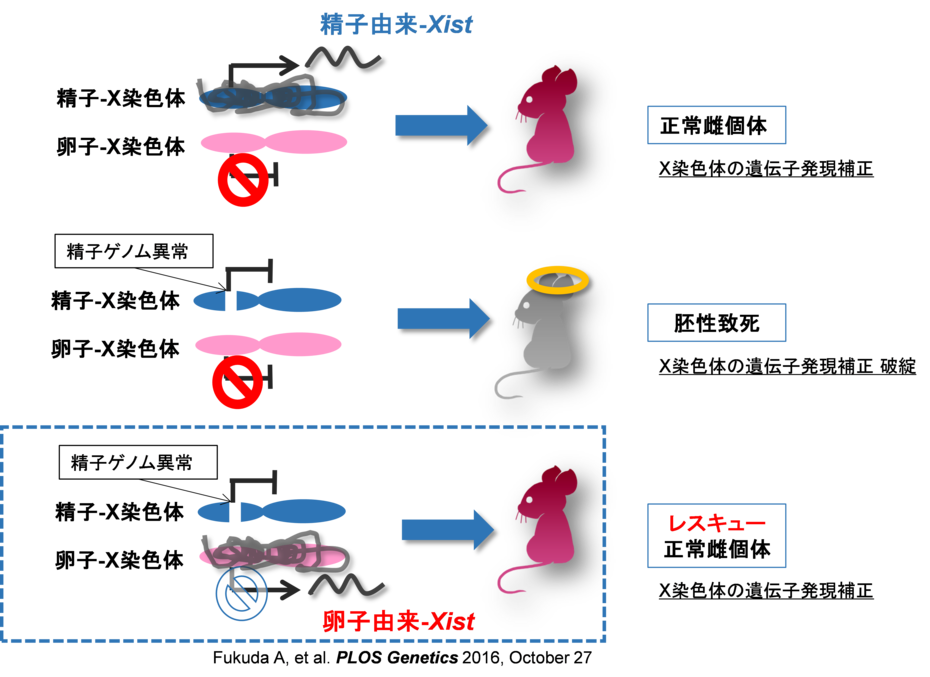
マウスの受精胚(雌)では精子由来のXistが働き、一方卵子由来のXistは働かないようにプログラムされている。このバランスが破綻すると流産となる。本研究では卵子由来のXistを人為的に働かせることで精子由来の致死性異常を救うことを可能にした。
X染色体不活性化の破綻は、着床後の正常な発生を阻害することから、原因不明の反復性流産との関連も示唆されます。さらに、早発卵巣機能不全(Premature Ovarian Failure; POF)でもX染色体不活性化の乱れとも関連性が指摘されてきました。
これら疾患では、ゲノムレベルでの異常が認められない症例も多い。本研究成果で、ゲノムへ手を加えること無しに眠っていた卵子の能力を引き出し受精胚を正常化させることが出来た。これは、ゲノムの外につく「しるし」は極めて機能的であり、その機能を明らかにしたことで後発性の原因不明不妊・不育症を克服する突破口となり得ます。
マウスの受精胚(雌)では精子由来のXistが働き、一方卵子由来のXistは働かないようにプログラムされている。このバランスが破綻すると流産となる。本研究では卵子由来のXistを人為的に働かせることで精子由来の致死性異常を救うことを可能にした。
X染色体不活性化の破綻は、着床後の正常な発生を阻害することから、原因不明の反復性流産との関連も示唆されます。さらに、早発卵巣機能不全(Premature Ovarian Failure; POF)でもX染色体不活性化の乱れとも関連性が指摘されてきました。
これら疾患では、ゲノムレベルでの異常が認められない症例も多い。本研究成果で、ゲノムへ手を加えること無しに眠っていた卵子の能力を引き出し受精胚を正常化させることが出来た。これは、ゲノムの外につく「しるし」は極めて機能的であり、その機能を明らかにしたことで後発性の原因不明不妊・不育症を克服する突破口となり得ます。
今後の展望・コメント
X染色体不活化機序を明らかにすることは、女性の細胞基本動態を理解することに必須であり、多領域にわたる女性医学の進展に大きく貢献するものです。ヒトでは、初期胚のX染色体不活化現象は未だ不明な点が多い。その一方で、X染色体不活化の乱れが様々な女性の疾患と関連することが報告されています。例えば、乳癌などではX染色体不活性化と腫瘍発症との関連性が指摘され世界的に研究が活発化しています。したがって、本研究成果が、卵巣腫瘍や乳癌などの女性腫瘍の発症機序解明に繋がると考えられます。
また、ヒトiPS及びES細胞(46,XX染色体型)では、長期培養によりX染色体不活性化機構が破綻するとの報告があります(参考文献2)。今回の発見は、個体発生の源となる初期胚のX染色体不活性化制御機構を明らかにするものであり、多能性幹細胞での制御機構にも役立つことでしょう。
これにより、今回の研究成果は安全で効果的な再生医療のためのES細胞やiPS細胞の品質に関わる重要な成果でもあり、再生医療の発展に大いに貢献するものであると考えます。
補足説明
① X染色体の遺伝子発現補正機構
哺乳類の雄では性染色体としてXとY染色体を1本ずつもち、雌はX染色体を2本もつ。雌の2つのX染色体のうちの一方が「X染色体不活性化(補足説明2)」という仕組みによって、働かない状態になっている。ショウジョウバエでは、雄(XY)のX染色体の遺伝子発現が雌(XX)のX染色体より2倍に高められている。一方、線虫では、雌雄同体(XX)の遺伝子発現量が、雄(XO)のX染色体の半分に抑えられている。
いずれの生物においても、このX染色体遺伝子発現機構が破綻すると致死となることから、X染色体の遺伝子発現補正が生き物の正常な発生にとって極めて重要である(参考文献3)。
② X染色体不活性化
X染色体上に位置するタンパク質をコードしない遺伝子であるXistが発現することで、そのX染色体全体の遺伝子発現が抑制される。雌の2本のX染色体の一方が不活性化される現象は、1961年にイギリスのメアリー・ライオン博士によって初めて報告されている。Xistは受精後から発現が開始されるが、その制御機構は長らく不明であった。
哺乳類の雄では性染色体としてXとY染色体を1本ずつもち、雌はX染色体を2本もつ。雌の2つのX染色体のうちの一方が「X染色体不活性化(補足説明2)」という仕組みによって、働かない状態になっている。ショウジョウバエでは、雄(XY)のX染色体の遺伝子発現が雌(XX)のX染色体より2倍に高められている。一方、線虫では、雌雄同体(XX)の遺伝子発現量が、雄(XO)のX染色体の半分に抑えられている。
いずれの生物においても、このX染色体遺伝子発現機構が破綻すると致死となることから、X染色体の遺伝子発現補正が生き物の正常な発生にとって極めて重要である(参考文献3)。
② X染色体不活性化
X染色体上に位置するタンパク質をコードしない遺伝子であるXistが発現することで、そのX染色体全体の遺伝子発現が抑制される。雌の2本のX染色体の一方が不活性化される現象は、1961年にイギリスのメアリー・ライオン博士によって初めて報告されている。Xistは受精後から発現が開始されるが、その制御機構は長らく不明であった。

卵子にはXist発現を抑制する「しるし」が付いている。受精胚を特定の物質で処理することで「しるし」を外しXistを活性化させる。今回、致死性精子ゲノム異常を卵子ゲノムが補償し正常個体へとレスキューした(点線四角)。
参考文献
- Fukuda A, Tomikawa J, Miura T, Hata K, Nakabayashi K, Eggan K, Akutsu H, Umezawa A.
"The Role of Maternal-Specific H3K9me3 Modification in Establishing Imprinted X-Chromosome Inactivation and Embryogenesis in Mice". Nature Communications, 2014; Nov 14; 5: 5464.
「しるし」は、ヒストン3(H3)の9番目のリジン(K)(アミノ酸)にメチル基(me)が3つ付加されていることである(H3K9me3)。これによりXistの発現が卵子側で抑制され卵子X染色体(Xm)全体が活性化される。 - Mekhoubad S, Bock C, de Boer AS, Kiskinis E, Meissner A, Eggan K. "Erosion of dosage compensation impacts human iPSC disease modeling." Cell Stem Cell 2012; 10(5): 595-609.
- 佐渡 敬「X染色体不活性化のメカニズムを解く」,総研大ジャーナル 9月号,2006
- 本件に関する取材連絡先
-
国立成育医療研究センター 企画戦略局 広報企画室
03-3416-0181(代表)
koho@ncchd.go.jp
月~金曜日(祝祭日を除く)9時〜17時
※医療関係者・報道関係者以外のお問い合わせは、受け付けておりません。



